eISSN 2444-7986
DOI: https://doi.org/10.14201/orl.28343
ARTÍCULO DE REVISIÓN
EVOLUCIÓN DEL TRATAMIENTO CON RADIOYODO EN EL CARCINOMA DIFERENCIADO DE TIROIDES
Evolution of radioiodine treatment in differentiated thyroid carcinoma
Pilar TAMAYO-ALONSO1,2 https://orcid.org/0000-0002-7466-514X
Paloma GARCÍA-TALAVERA1 https://orcid.org/0000-0001-7746-7555
Carlos MONTES-FUENTES3,2 https://orcid.org/0000-0002-1728-5706
Esther MARTÍN-GÓMEZ1 https://orcid.org/0000-0001-6019-5928
Enrique MARTÍN-GÓMEZ1
1Servicio de Medicina Nuclear. Hospital Universitario de Salamanca. 2Instituto de Investigación Biomédica de Salamanca (IBSAL). 3Servicio de Física Médica. Hospital Universitario de Salamanca. Salamanca. España.
Correspondencia: ptamayo@usal.es
Fecha de recepción: 3 de febrero de 2022
Fecha de aceptación: 25 de febrero de 2022
Fecha de publicación: 26 de febrero de 2022
Fecha de publicación del fascículo: 22 de junio de 2022
Conflicto de intereses: Los autores declaran no tener conflictos de intereses
Imágenes: Los autores declaran haber obtenido las imágenes con el permiso de los pacientes
Política de derechos y autoarchivo: se permite el autoarchivo de la versión post-print (SHERPA/RoMEO)
Licencia CC BY-NC-ND. Licencia Creative Commons Atribución-NoComercial-SinDerivar 4.0 Internacional
Universidad de Salamanca. Su comercialización está sujeta al permiso del editor
RESUMEN: En marzo de 2021 se ha celebrado el 80 aniversario de la primera aplicación terapéutica del radioyodo (RAI) por Saúl Hertz a una paciente con hipertiroidismo el 31 de marzo de 1936. El éxito alcanzado impulsó su utilización en el tratamiento del carcinoma diferenciado de tiroides (CDT) y supuso un cambio de paradigma en el manejo de las enfermedades tiroideas. Desde entonces, han cambiado las estrategias de administración de RAI a pacientes con CDT y aún hoy día existen controversias. En esta revisión vamos a comentar las diferentes estrategias adoptadas en la administración de RAI a pacientes con CDT a lo largo de estas 8 décadas y cuáles son las controversias actuales en cuanto a qué pacientes con CDT hay que administrar RAI y qué actividad de RAI se debe administrar.
PALABRAS CLAVE: carcinoma diferenciado de tiroides; radioyodo; 131I; tratamiento; indicaciones; controversiesas.
SUMMARY: March 2021 has marked the eightieth anniversary of targeted radionuclide therapy, recognizing the first use of radioactive iodine (RAI) to treat thyroid disease by Dr. Saul Hertz on March 31, 1941. Success with hyperthyroidism fueled a seamless, almost intuitive transition to the use of RAI in thyroid carcinoma and marked the beginning of a new paradigm for thyroid cancer diagnosis and management. Since then, several therapeutic strategies have been adopted in the management of patients with differentiated thyroid cancer (DTC) and there are still controversies today regarding which patients with DTC should be administered RAI and what RAI activity should be administered, issues that will be commented in this review.
KEYWORDS: differentiated thyroid cancer; radioactive iodine; 131I; therapy; indications; controversies.
INTRODUCCIÓN
El uso de radioyodo como agente terapéutico de la patología tiroidea tiene su origen en los trabajos pioneros llevado a cabo por Saúl Hertz, desde mediados de 1936 hasta principios de 1940, que condujeron a la primera administración terapéutica de yodo radiactivo a una paciente con hipertiroidismo en 1941 [1]. El 12 de noviembre de 1936, Hertz, Jefe de la Unidad de Tiroides del Hospital General de Massachusetts, en Boston (USA), asistió a una reunión en la Universidad de Harvard, en la que Karl Compton, presidente del Instituto Tecnológico de Massachusetts (ITM) fue invitado a dar una conferencia titulada «Qué puede hacer la Física por la Biología y Medicina». Al finalizar la misma, Hertz le preguntó: «¿Puede obtenerse yodo radiactivo artificialmente?». Hertz llevaba varios años estudiando la fisiología del yodo en el tiroides, con el objeto de resolver el hipertiroidismo sin necesidad de cirugía. Un mes después, Compton le contestó que sí se puede obtener yodo radiactivo artificialmente.
Hertz, junto con Arthur Roberts, un joven físico nuclear del ITM, empezó una serie de experimentos en conejos que demostraron que la glándula tiroidea bociógena retenía más cantidad de radioyodo (RAI) que una glándula normal. Hertz y Roberts trasladaron sus conocimientos, procedentes de sus experimentos en conejos, a pacientes con patología tiroidea y el 31 de marzo de 1941, Hertz administró la primera dosis de RAI a una paciente con hipertiroidismo. Así, en 2021 se ha celebrado el 80 aniversario del primer uso terapéutico del RAI. De 1941 a 1943, Hertz trató 29 pacientes con hipertiroidismo, de los cuales 20 se curaron y 9 no respondieron al RAI; los resultados fueron publicados en 1946 por JAMA [2]. En 1943, Hertz interrumpió su trabajo para alistarse en la Marina de los Estados Unidos, para servir a su patria durante la II Guerra Mundial. Tras finalizar la guerra, en 1946, Hertz entró a formar parte de la Sociedad Americana de Investigadores Clínicos por su revolucionario trabajo en el desarrollo de la primera modalidad teragnóstica en medicina: El tratamiento con RAI para los trastornos tiroideos [3]. En 1949, Hertz fundó el primer servicio de Medicina Nuclear en el Massachusetts’s Women’s Hospital. Por todo ello, Saúl Hertz (Figura 1) es considerado el pionero de la Medicina Nuclear y el padre de la primera teragnosis en medicina.

Figura 1. Saúl Hertz descubrió el uso del radioyodo para las aplicaciones médicas, por lo que es considerado el pionero de la Medicina Nuclear y el padre de la Teragnosis.
PRIMER USO DEL RAI EN EL TRATAMIENTO DEL CÁNCER DE TIROIDES
El éxito del tratamiento con RAI en el hipertiroidismo, alcanzado por Hertz, impulsó, de forma casi intuitiva, el uso del RAI en el cáncer de tiroides. El 11 de marzo de 1943, Samuel Seidlin, endocrino del Hospital Montefiori de Nueva York, administró la primera dosis de RAI a un paciente con cáncer de tiroides metastásico. Paciente que se había sometido a los 30 años a una tiroidectomía total por presentar bocio compresivo subesternal y cuyo estudio anatomo-patológico informó de la presencia de un adenoma maligno. Tras la tiroidectomía total, el paciente no se encontraba hipotiroideo, todo lo contrario, mantuvo un hipertiroidismo durante más de 15 años, hasta que su estado de salud fue tan caótico que tuvo que ingresar para ser tratado con Lugol, con el fin de bloquear la síntesis de hormonas tiroideas. Sin embargo, su estado clínico no mejoró y fue entonces cuando Seidlin se planteó realizar un tratamiento con RAI. Previamente había consultado con Hertz la posibilidad de administrar RAI para manejar las metástasis hiperfuncionantes de este paciente, Hertz manifestó su acuerdo y el día 11 de marzo de 1943, Seidlin le administró la primera dosis de 17 mCi de RAI, a la que siguieron otras 15 dosis más, en un intervalo de 22 meses, hasta alcanzar una dosis acumulada de 268 mCi. Tras la primera dosis, el paciente empezó a experimentar una gran mejoría clínica, que progresivamente aumentó con las sucesivas dosis.
Este caso ganó gran notoriedad y fue publicitado en medios nacionales e internacionales. JAMA publicó en 1946 el éxito del primer tratamiento con RAI en cáncer de tiroides metastásico [4]. El paciente perdió el anonimato en 1949, cuando la revista Life Magazine publicó un extenso artículo titulado: «El radioyodo detiene un tipo de cáncer», con el subtítulo «El compuesto radiactivo provoca la recuperación de pacientes que mueren de cáncer de tiroides» (Figura 2). Este artículo muestra las fotografías de Bernard Brunstein antes y después de ser curado de cáncer de tiroides con yodo radiactivo. La fotografía del antes, muestra un hombre caquéctico y frágil, que contrasta con la fotografía del después, que muestra un hombre de apariencia saludable y con cara sonriente. A pesar de este éxito con los medios, Seidlin se sentía algo escéptico de haber curado realmente el cáncer y pensó que lo que había curado era el hipertiroidismo del paciente. De hecho, poco más de dos años después de este popular artículo, Brunstein murió en 1952 de un carcinoma anaplásico, confirmado histológicamente [5].

Figura 2. El popular artículo publicado el 31 de octubre de 1949 por Life Magazine, mostrando al famoso paciente de Samuel Seidlin, quien fue curado del cáncer de tiroides mediante el tratamiento con yodo radiactivo (Life Magazine).
Esta descripción tan convincente del RAI como una terapia milagrosa para el cáncer de tiroides produjo una fuerte impresión en la población y en los médicos en ejercicio. La retórica del artículo impregnó la enseñanza médica e influyó en el pensamiento clínico, que pronto colocó al tratamiento con RAI como la opción terapéutica central para el tratamiento del cáncer diferenciado de tiroides (CDT), en todo el mundo.
El RAI, que es el primer radiofármaco teragnóstico, tiene sus orígenes ontológicos que se remontan al 12 de noviembre de 1936 y cambió para siempre el paradigma de manejo de las enfermedades tiroideas [6]. En 1951, el 131I fue el primer radiofármaco aprobado por the Food and Drug Administration (FDA) para el tratamiento de enfermedades tiroideas.
EXPANSIÓN DEL TRATAMIENTO CON RAI
La radioablación del cáncer de tiroides realizada por Seidlin suscitó importantes interrogantes en cuanto a la captación de RAI por los tumores tiroideos. Un interesante estudio autorradiográfico, llevado a cabo por Fitzgerald y col., demostró que de 100 pacientes con cáncer de tiroides, solo 47 pacientes mostraban captación de 131I y la posibilidad de que un tumor concentrara RAI se correlacionó con lesiones foliculares que fabricaban coloide funcional [7]. Beierwaltes, uno de los pioneros más eminentes de la Medicina Nuclear, escribió en su libro Clinical Use of Radioisotopes que menos del 50% de los cánceres de tiroides mostraban captación de RAI [8].
Se puede decir que Seidlin, Beierwaltes y sus colaboradores siguieron trabajando sobre los cimientos establecidos por Hertz, en cuanto al uso del RAI en el hipertiroidismo y sentaron las bases conceptuales para el uso de RAI en el cáncer de tiroides. El fundamento para aplicar RAI en el cáncer de tiroides fue claramente establecido en 1957, cuando se afirmó «es recomendable administrar RAI para finalizar el trabajo que comenzó el cirujano» [6]. En 1963, Haynie and Beierwaltes publicaron en JAMA los resultados del tratamiento con RAI de 200 pacientes con cáncer de tiroides tratados con RAI, entre 1947 y 1960, en los que el 67% de los pacientes con metástasis ganglionares y el 53% de los pacientes con metástasis a distancia estaban libre de enfermedad, tras 14 años de seguimiento [9]. Beierwaltes reflejó el papel del RAI en el cáncer de tiroides en su autobiografía Love of Life: «El primer paso en el tratamiento del cáncer de tiroides es la tiroidectomía total. El segundo paso mantener a los pacientes sin hormonas tiroideas durante seis semanas. El tercer paso realizar un rastreo del cuello y de todo el cuerpo con yodo radiactivo para buscar restos tiroideos o metástasis. Después administrar una dosis terapéutica de RAI: 150 mCi para ablación de restos tiroideos, 175 mCi en caso de afectación ganglionar regional y 200 mCi en caso de afectación metastásica fuera del cuello» [10]. Bierwaltes estableció los cimientos, pero la metodología para la realización del tratamiento del cáncer de tiroides con RAI se ha ido desarrollando con el paso de los años y hoy día aún continúa en debate.
DEL «ENSAYO Y ERROR» A UNA «PRÁCTICA HETEROGÉNEA»
Los primeros pacientes con cáncer de tiroides tratados con RAI recibieron múltiples pequeñas dosis de RAI a intervalos variables de tiempo. Los efectos de cada dosis fueron meticulosamente evaluados en cada paciente, registrando todas las variables y parámetros clínicos, para evaluar la respuesta clínica; dada la ausencia de medios que pudieran estudiar la distribución del radioisótopo en el paciente, con la intención de hacer un diagnóstico y poder identificar la extensión y distribución de la enfermedad, y sobre todo estimar la dosis absorbida. De ahí que se utilizaran dosis relativamente bajas (desde 2 mCi hasta 50 mCi) y se observara y registrara minuciosamente la respuesta en cada paciente. Fue una práctica de ensayo y error, representando cada paciente la oportunidad de realizar modificaciones que mejoraran esta emergente modalidad terapéutica [11].
La experiencia acumulada condujo a mediados de 1949 a las siguientes conclusiones: 1) el mejor tratamiento para el cáncer de tiroides era la cirugía, 2) la captación de RAI en las metástasis era posible y aumentaba cuando se extirpaba todo o la mayoría de tejido tiroideo, 3) la elevación sérica de los niveles de hormona estimulante del tiroides (TSH) estimulaba la captación de RAI, 4) múltiples administraciones de pequeñas dosis podían producir supresión de la médula ósea y 5) múltiples administraciones a menudo conducían a la pérdida de la avidez del RAI por el carcinoma diferenciado de tiroides (CDT) [11]. Estas conclusiones sentaron las bases de las dos tendencias claves que ofrecían formas conceptualmente diferentes de resolver las deficiencias observadas. Una, liderada por el grupo del Memorial Sloan Kettering Cancer Center de Nueva York, defendía administrar la máxima actividad tolerada, determinada mediante complejos cálculos dosimétricos [12]. La otra, liderada por la Universidad de Michigan, defendía administrar un rango empírico de actividad, variable según la extensión de la enfermedad, que iba desde los 100 mCi, en caso de que solo hubiera presencia de restos tiroideos, hasta los 175 mCi en caso de enfermedad metastásica, pasando por los 150 mCi en caso de afectación ganglionar cervical [13]. De aquí se paso a administrar una dosis estándar de 100 mCi a todos los paciente con CDT hasta que el rastreo pos-tratamiento fuera negativo [14]. La efectividad terapéutica de estos diferentes procedimientos se desconoce, porque no hay evidencia de estudios adecuadamente diseñados y las comparaciones entre estudios suscitan muchas críticas.
La administración empírica de una dosis fija resultó en un amplio rango de dosis de RAI administrado y condujo a una gran heterogeneidad en la práctica clínica.
MANEJO ACTUAL DEL CÁNCER DIFERENCIADO DE TIROIDES
El diagnóstico y el manejo del cáncer diferenciado de tiroides (CDT) se basan en una clasificación histológica internacional y en la presencia de alteraciones genéticas específicas en el tumor. La clasificación de la OMS de 2017 establece 4 tipos de CDT que derivan de las células tiroideas epiteliales, que son: a) el carcinoma papilar de tiroides (CPT), que es el más frecuente (>85%), b) el carcinoma folicular (CF) de tiroides con tres variantes: CF mínimamente invasivo con invasión capsular, el CF encapsulado invasivo vascular y el CF ampliamente invasivo, c) el cáncer de células de Hürthle y d) el carcinoma pobremente diferenciado.
El CDT representa el 90% de los cánceres de tiroides y en más del 90% de los casos está localizado en el cuello. Tiene un excelente pronóstico, con una supervivencia a 5 años de 98,3% y una tasa de mortalidad específica de 0.4/100000 habitantes.
El tratamiento estándar del CDT incluye tiroidectomía total o subtotal, tratamiento hormonal sustitutivo y tratamiento con 131I bajo estimulación de TSH, bien de forma endógena, suprimiendo el tratamiento hormonal (levotiroxina), o exógena mediante la administración de TSH recombinante humana (rhTSH). Sin embargo, el manejo terapéutico óptimo debe adaptarse a cada paciente, según su pronóstico. Para establecer el pronóstico de cada paciente con CDT se usa la clasificación tumor-nódulo-metástasis (TNM) de la American Joint Comission on Cancer (AJCC) (8ª edición) y la estratificación de riesgo de recidiva de la American Thyroid Association (ATA) 2015 [15]. En la estratificación de riesgo ATA 2015, los pacientes son clasificados como bajo (<5%), intermedio (5-20%) y alto riesgo (>20%) de recidiva. Más del 80% de los pacientes con CDT son clasificados como de bajo riesgo [15,16].
¿POR QUÉ ADMINISTRAR RAI?
El tratamiento con 131I es un término amplio que abarca los tres objetivos primarios asociados con la administración de RAI (Tabla 1) [17,18], que son:
1º. Ablación de restos tiroideos. Es la destrucción del tejido tiroideo residual, probablemente benigno, tras la tiroidectomía total, para facilitar el seguimiento, mediante la determinación de los niveles séricos de tiroglobulina (Tg) y el rastreo corporal (RC) con 131I, y la estadificación inicial.
2º. Tratamiento adyuvante. Tratamiento que se da tras la cirugía para disminuir el riesgo de recidiva (pretende destruir focos tumorales subclínicos tras la cirugía, sospechados, pero no demostrados), para mejorar la supervivencia específica de enfermedad (SEE), disminuir la tasa de recidivas y aumentar la supervivencia libre de progresión (SLP).
3º. Tratamiento de enfermedad conocida (estructural o bioquímica). Su objetivo es destruir focos de enfermedad de CDT persistentes o recurrentes con el propósito de aumentar el intervalo libre de progresión, la supervivencia global (SG) y SEE. Puede ser con intención curativa o paliativa.
Tabla 1. Objetivos del tratamiento con 131I.
Tratamiento con 131I |
|||
Objetivos |
Ablación de restos |
Tratamiento adyuvante |
Tratamiento de enfermedad conocida |
Estadificación inicial |
√ |
√ |
√ |
Facilitar el seguimiento |
√ |
√ |
√ |
Mejorar la supervivencia específica de enfermedad |
– |
√ |
√ |
Disminuir recidivas |
– |
√ |
– |
Mejorar la supervivencia libre de progresión |
– |
√ |
√ |
Intención curativa |
– |
√ |
√ |
Intención paliativa |
– |
– |
√ |
Está claro que hay que administrar RAI a los pacientes con CDT tras la cirugía. La controversia está en a quién hay que administrarlo, cómo y cuánto hay que administrar.
¿A QUÉ PACIENTES HAY QUE ADMINISTRAR RAI?
Mazzaferri y col. publicaron en 1994 que la administración de RAI, a pacientes con tumores >1,5 cm y sin evidencia inicial de metástasis a distancia, disminuía la tasa de recidivas y aumentaba la supervivencia tras un seguimiento de más de 15 años [19]. Esta estrategia fue seguida en muchos centros y usada en gran número de pacientes con CDT. Pero desde que se hicieron los primeros estudios de este trabajo, a principios de 1970, hasta hoy han pasado muchos años y han cambiado muchas cosas. Han cambiado las técnicas diagnósticas, ahora contamos con equipos con mayor resolución diagnóstica, test ultrasensibles de Tg y se han publicado distintas guías, como la ATA 2009 y 2015, etc.
Por todo esto, es evidente que tenemos que cambiar de estrategia. Cambiar la estrategia de dosis empírica estándar de 100 mCi con supresión hormonal a tratamientos individualizados, basado en factores pronósticos de la enfermedad [20]. El beneficio esperado del tratamiento con RAI tras la cirugía depende del riesgo de cada paciente y la cantidad de RAI que administremos debe ser tan baja como sea posible, para evitar exposiciones a las radiaciones innecesarias, acorde con los criterios de radioprotección. Por lo tanto, la dosis a administrar va a variar en función del riesgo del paciente.
PACIENTES CON CDT DE MUY BAJO RIESGO
A los pacientes con tumores <1cm (microcarcinomas), en ausencia de otros factores de riesgo, se les considera pacientes de muy bajo riesgo y la actitud terapéutica de estos pacientes es la vigilancia activa, mediante ecografías cervicales cada 6 meses durante los 2 primeros años y luego anualmente [21].
PACIENTES CON CDT DE BAJO RIESGO
Los pacientes con CDT de bajo riesgo tienen por definición bajo riesgo de recidiva (<5%) y menor riesgo de muerte relacionada con el cáncer.
En pacientes con bajo riesgo, no se ha demostrado que la administración de RAI tras la cirugía tenga efectos beneficiosos sobre la supervivencia y los resultados sobre las recidivas son contradictorios, basándonos en estudios retrospectivos [22–24]. Estos datos no son sorprendentes si tenemos en cuenta que solo el 2,5% de los pacientes tiene enfermedad persistente estructural tras la cirugía [25]. Por ello, la administración de RAI en pacientes con CDT de bajo riesgo debe estar basada en indicadores pronósticos obtenidos durante la cirugía, en los niveles séricos de Tg tras la cirugía, en los hallazgos del RC con RAI y de la ecografía poscirugía, y finalmente teniendo en cuenta las preferencias de los pacientes.
Actualmente están en marcha dos estudios clínicos prospectivos, multicéntricos y randomizados, el IoN (Iodine or Not) en Inglaterra y ESTIMABL 2 en Francia (clinicaltrials.gov identifiers NCT01398085 and NCT01837745, respectivamente), en los que se compara la administración de 1.110 MBq (30 mCi) de 131I frente a no administrar 131I (seguimiento), en pacientes de bajo riesgo, y en el caso del IoN incluye pacientes de riesgo intermedio también [26,27]. Los primeros resultados del estudio ESTIMABL2, que incluía pacientes pT1am N0 Nx, pT1b No Nx, muestran no inferioridad de la estrategia de seguimiento en comparación con la estrategia de administración de 1.110 MBq de RAI tras rhTSH en pacientes con CDT de bajo riesgo, a los tres años de la randomización. Los resultados de este estudio indican que no es necesario la ablación con RAI en este grupo de pacientes, que representa, aproximadamente, el 50% de los pacientes con CDT [28].
PACIENTES CON CDT DE RIESGO INTERMEDIO
En pacientes de riesgo intermedio, el riesgo de persistencia de enfermedad o recidiva (>5-20%) es mayor que en los pacientes de bajo riesgo; sin embargo, el riesgo de muerte sigue siendo pequeño. Este grupo de pacientes es heterogéneo y la estrategia terapéutica a seguir depende de cada paciente [29].
La indicación de tratamiento con RAI tras la cirugía se basa en los criterios establecidos para los pacientes con CDT de bajo riesgo. El mayor beneficio se espera en pacientes de edad avanzada, con histologías agresivas, extensión ganglionar cervical o fuera del cuello; en estos pacientes debe administrarse RAI como tratamiento adyuvante.
PACIENTES CON CDT DE RIESGO ALTO
Los pacientes con riesgo alto representan el 5-10% de todos los pacientes con CDT. Tienen mayor riesgo de persistencia de enfermedad y recidiva (>20%) que los pacientes con CDT de bajo e intermedio riesgo y mayor riesgo de muerte por cáncer.
Tras la tiroidectomía total está indicada la administración de RAI, tras supresión de la hormona tiroidea. Los objetivos de la administración son la ablación de restos tiroideos y la destrucción de enfermedad residual. En estos pacientes de alto riesgo, varios estudios retrospectivos han puesto de manifiesto que la administración de RAI mejora la supervivencia libre de enfermedad (SLE) y la SG [18,30].
¿QUÉ DOSIS DE RAI HAY QUE ADMINISTRAR?
La cantidad de RAI que hay que administrar debe ser tan baja como sea posible, para evitar exposición innecesaria de los pacientes a las radiaciones, particularmente cuando se espera poco beneficio, acorde con los criterios de radioprotección.
PACIENTES CON CDT DE BAJO RIESGO
En pacientes con CDT de bajo riesgo se recomienda administrar una actividad baja de 131I, 1.110 MBq (30 mCi), tras la administración de rhTSH (Thyrogen®) [31,32]. Recomendación que está avalada por los resultados obtenidos por Schlumberger et al. [33] y Dehbi H-M et al. [34], quienes tras un seguimiento de 5 años de pacientes con CDT de bajo riesgo tratados con baja actividad de 131I, observaron que la tasa de recidivas no fue superior respecto al grupo de pacientes tratados con dosis altas, 3700 MBq (100 mCi) de 131I. Estos resultados validan el uso de 1.110 MBq (30 mCi) de 131I, tras la administración de rhTSH, para la terapia adyuvante en pacientes con CDT de bajo riesgo.
PACIENTES CON CDT DE RIESGO INTERMEDIO
En pacientes con CDT de riesgo intermedio, si el objetivo del tratamiento con RAI es la ablación, la dosis a administrar debe ser baja (1.100 MBq); sin embargo, si el objetivo es tratamiento adyuvante o tratamiento de enfermedad persistente, deben administrase dosis más altas (3,7 GBq o incluso más) y realizar un rastreo a los 3-7 días de la administración [29].
PACIENTES CON CDT DE RIESGO ALTO
En pacientes de CDT de alto riesgo, después de la cirugía está indicado administrar 3,7 GBq o más de 131I, tras supresión de la hormona tiroidea, y realizar un rastreo a los 3-7 días de la administración [29].
La tercera parte de los pacientes con CDT de alto riesgo alcanzan excelente respuesta al tratamiento a los 6-12 meses de seguimiento y el riesgo de recidiva es del 15% o menos [35]. Pacientes con niveles detectables de Tg bajo tratamiento con levotiroxina y sin evidencia de enfermedad, precisan estudios de imagen, sobre todo cuando los niveles de Tg aumentan. Si se objetiva enfermedad persistente o recidiva de la enfermedad debe administrarse dosis adicionales de RAI, siempre que las lesiones muestren avidez por éste; de lo contrario, debe considerarse enfermedad refractaria al RAI y no deben suministrarse más dosis de RAI. Si los niveles de Tg son altos y las técnicas convencionales de imagen (ecografía, RC con RAI y la TC) no ponen de manifiesto la enfermedad existente, debe solicitarse un estudio PET con 18F-FDG para tratar de localizar los focos de enfermedad.
PACIENTES CON CDT CON METáSTASIS A DISTANCIA
La incidencia de metástasis a distancia en CDT es 5-7/1.000.000 habitantes. En la mitad de los casos, las metástasis están presentes al diagnóstico y son más frecuentes en pacientes muy jóvenes o de edad avanzada; así como en tumores de gran tamaño y con histologías agresivas, con invasión capsular y vascular y afectación ganglionar extensa. Las metástasis se localizan principalmente en pulmón y en hueso [15,36].
Clásicamente, el tratamiento con RAI de las metástasis se ha basado en el uso de dosis altas de 131I. La dosis administrada puede ser una actividad estándar de 5,55 GBq cada 6/12 meses (Figura 3) o una actividad mayor basada en cálculos dosimétricos, tras supresión del tratamiento hormonal (levotiroxina durante 4 semanas o liotironina durante 2 semanas) consiguiendo mayor captación de RAI por parte de las metástasis que con la administración de rhTSH [37], hasta una dosis acumulada de >22 GBq. Se pueden administrar dosis mayores, pero es poco probable que se alcance una respuesta completa [36]. Una respuesta completa se alcanza en el 30% de los pacientes con metástasis a distancia, especialmente en caso de pacientes jóvenes, con pocas metástasis que presentan inicialmente alta captación de RAI [36]. Desafortunadamente, no todas las metástasis con captación de 131I responden al tratamiento con RAI, especialmente en caso de mucha carga tumoral, pacientes de edad avanzada y presencia de captación de 18F-FDG en el estudio PET/CT [38]. Cuando no se produce captación de RAI en las lesiones metastásicas o cuando las metástasis progresan a pesar de la presencia de captación (Figura 4), la enfermedad se considera refractaria al RAI y no se debe administrar más tratamientos con RAI [39]. Sin embargo, se pueden dar dos circunstancias. La primera, cuando hay captación de RAI en la mayoría de las lesiones, que pueden beneficiarse de la administración de 131I, y ausencia en pocas lesiones, que pueden beneficiarse de tratamientos locales. La segunda se da en pacientes que han alcanzado la dosis acumulada de 22 GBq y tienen evidencia de enfermedad; en estos pacientes la administración de dosis adicionales de RAI debe decidirse de forma individualizada, basándose en la tolerancia y eficacia de los tratamientos previos y el nivel de captación de 131I en las metástasis [29].

Figura 3. Carcinoma papilar de tiroides con infiltración ganglionar y metástasis pulmonares en una paciente de 24 años. Rastreo corporal obtenido a los 5 días tras la administración de 150 mCi de 131I (A), en el que se visualizan focos de captación del radionúclido en adenopatías en región látero-cervical izquierda y región anterior del cuello y en ambos campos pulmonares. A los 6 meses se le administró una segunda dosis de 150 mCi de 131I y en el rastreo pos-tratamiento (B) se observa una significativa respuesta al tratamiento con RAI, con desaparición de las lesiones a nivel pulmonar y disminución del tamaño y de la intensidad de captación del radionúclido en las adenopatías localizadas en región látero-cervical izquierda y a nivel paratraqueal superior derecho. Los niveles de tiroglobulina descendieron de 529 ng/ml a 91,86 ng/ml bajo estimulación con rhTSH.
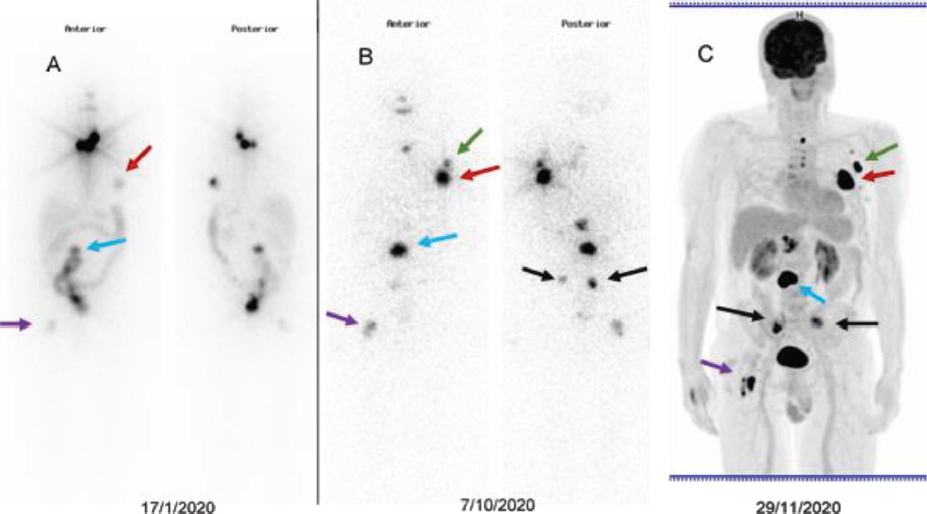
Figura 4. Paciente de 57 años con carcinoma papilar de tiroides con metástasis óseas en parrilla costal izquierda (flecha roja), vértebras (flecha azul), palas iliacas (flechas negras) y fémur derecho (flecha morada), tal como se visualiza en el rastreo pos-tratamiento tras la administración de 5,55 GBq de RAI (A). A los 10 meses se le administra otra dosis de 5,55 GBq de RAI y en el rastreo pos-tratamiento (B) se observa que han aumentado de tamaño las lesiones óseas y han aparecido nuevos focos de actividad, que corresponden a infiltración ganglionar en axila izquierda (flecha verde), lesiones que muestran gran avidez por la 18F-FDG en el estudio PET/CT (C). Se constata progresión de la enfermedad a pesar de mostrar las lesiones avidez por el RAI, la enfermedad se considera refractaria y se ha cesado la administración de RAI.
PREPARACIÓN PARA LA ADMINISTRACIÓN DE RAI
ELEVACIóN DE TSH
Se precisan niveles séricos de TSH altos (>30 mU/L), que estimulen el receptor-TSH, para aumentar la captación de yodo, cuando la administración de RAI está indicada para tratamiento y/o estudios diagnósticos y/o determinaciones de niveles séricos de Tg. Esto se llevó a cabo tradicionalmente suprimiendo el tratamiento de hormonas tiroideas (levotiroxina) durante 4 semanas. Sin embargo, la introducción de la rhTSH a finales de 1990 supuso una importante ventaja sobre el método de supresión hormonal, al mostrar que era un método seguro, eficaz y que no producía hipotiroidismo en los pacientes. Basándonos en la evidencia, la administración de rhTSH es preferida para la ablación con RAI en pacientes con CDT de bajo riesgo. Por el contrario, la supresión del tratamiento hormonal es el procedimiento recomendado en pacientes de alto riesgo. No obstante, el método de estimulación debe ser personalizado teniendo en cuenta las variables clínicas, patológicas, bioquímicas y de imagen [37].
DIETA BAJA EN YODO
La exposición a excesivas cantidades de yodo estable puede influir sobre la captación diagnóstica o terapéutica de RAI. Así, hay profesionales que están a favor de una dieta baja en yodo, así como evitar exposición a agentes yodados (ej.: agentes de contraste, amiodarona y otros medicamentes que contienen yodo) durante 1-2 semanas antes de la administración de RAI. Sin embargo, no hay estudios prospectivos que determinen el valor de corte que pueda interferir con la captación de RAI [40].
CONCLUSIONES
El primer uso terapéutico de RAI en marzo de 1941, del que se ha celebrado el 80 aniversario en 2021, cambió para siempre el paradigma de manejo de las enfermedades tiroideas, entre ellas el CDT. Desde entonces, han cambiado las estrategias de administración de RAI a pacientes con CDT y aún hoy día existen controversias. La administración de RAI puede ser para ablación de restos tiroideos y para tratamiento de enfermedad no conocida (adyuvante) y conocida. En pacientes con CDT de muy bajo riesgo (microcarcinomas) no está indicado administrar RAI tras la cirugía. En pacientes con CDT de bajo riesgo, en los que esté indicado administrar RAI, la estrategia es administrar 1100 MBq de 131I tras rhTSH. En pacientes con CDT de intermedio-alto riesgo, se recomienda administrar 3700 MBq de 131I o actividades mayores y en CDT metastásico, se recomienda 3700 MBq o más, cada 6-12 meses hasta dosis acumulada de 22 GBq, si existe avidez por el RAI.
BIBLIOGRAFÍA
1.Fahey FH, Grant FD, Thrall JH. Saul Hertz, MD, and the birth of radionuclide therapy. Vol. 4, EJNMMI Physics. 2017. p. 15.
2.Hertz S, Roberts A. Radioactive iodine in the study of thyroid physiology; the use of radioactive iodine therapy in hyperthyroidism. J Am Med Assoc. 1946 May;131:81–6.
3.Howell JD. A history of the American Society for Clinical Investigation. J Clin Invest. 2009 Apr;119(4):682–97.
4.Seidlin SM, Marinelli LD, Oshry E. Radioactive iodine therapy; effect on functioning metastases of adenocarcinoma of the thyroid. J Am Med Assoc. 1946 Dec;132(14):838–47.
5.Surks MI. Milestones in thyroid research at Montefiore Medical Center, 1920-2011: history and personal reflections. Endocr Pract. 2013;19(1):172–4.
6.Ehrhardt JDJ, Güleç S. A Review of the History of Radioactive Iodine Theranostics: The Origin of Nuclear Ontology. Mol Imaging Radionucl Ther. 2020 Oct;29(3):88–97.
7.Fitzgerald PJ, Foote FWJ, Hill RF. Concentration of I131 in thyroid cancer, shown by radioautography; a study of 100 consecutive cases showing the relation of histological structure to the function of thyroid carcinoma. Cancer. 1950 Jan;3(1):86–105.
8.Bierwaltes W, Johson P, Solari AJ. Clinical use of radioisotopes. Philadelphia: W.B. Saunders Co; 1957. 150 p.
9.Haynie TP, Nofal MM, Beierwaltes WH. Treatment of thyroid carcinoma with I-131. Results at fourteen years. JAMA. 1963 Feb;183:303–6.
10.Bierwaltes W. Love of life:autobiographical sketches. New York: Vantage Press; 1996. 76–77 p.
11.Slonimsky E, Tulchinsky M. Radiotheragnostics Paradigm for Radioactive Iodine (Iodide) Management of Differentiated Thyroid Cancer. Curr Pharm Des. 2020;26(31):3812–27.
12.Benua RS, Cicale NR, Sonenberg M, Rawson RW. The relation of radioiodine dosimetry to results and complications in the treatment of metastatic thyroid cancer. Am J Roentgenol Radium Ther Nucl Med. 1962 Jan;87:171–82.
13.Beierwaltes WH, Rabbani R, Dmuchowski C, Lloyd R V, Eyre P, Mallette S. An analysis of “ablation of thyroid remnants” with I-131 in 511 patients from 1947-1984: experience at University of Michigan. J Nucl Med. 1984 Dec;25(12):1287–93.
14.Deandreis D, Rubino C, Tala H, Leboulleux S, Terroir M, Baudin E, et al. Comparison of Empiric Versus Whole-Body/-Blood Clearance Dosimetry-Based Approach to Radioactive Iodine Treatment in Patients with Metastases from Differentiated Thyroid Cancer. J Nucl Med. 2017 May;58(5):717–22.
15.Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016 Jan;26(1):1–133.
16.Tuttle RM, Tala H, Shah J, Leboeuf R, Ghossein R, Gonen M, et al. Estimating risk of recurrence in differentiated thyroid cancer after total thyroidectomy and radioactive iodine remnant ablation: using response to therapy variables to modify the initial risk estimates predicted by the new American Thyroid Association staging system. Thyroid. 2010 Dec;20(12):1341–9.
17.Van Nostrand D. Selected Controversies of Radioiodine Imaging and Therapy in Differentiated Thyroid Cancer. Endocrinol Metab Clin North Am. 2017 Sep;46(3):783–93.
18.Tuttle RM, Ahuja S, Avram AM, Bernet VJ, Bourguet P, Daniels GH, et al. Controversies, Consensus, and Collaboration in the Use of (131)I Therapy in Differentiated Thyroid Cancer: A Joint Statement from the American Thyroid Association, the European Association of Nuclear Medicine, the Society of Nuclear Medicine and Molecular Imaging, and the European Thyroid Association. Thyroid. 2019 Apr;29(4):461–70.
19.Mazzaferri EL, Jhiang SM. Long-term impact of initial surgical and medical therapy on papillary and follicular thyroid cancer. Am J Med. 1994 Nov;97(5):418–28.
20.Hay ID, Johnson TR, Kaggal S, Reinalda MS, Iniguez-Ariza NM, Grant CS, et al. Papillary Thyroid Carcinoma (PTC) in Children and Adults: Comparison of Initial Presentation and Long-Term Postoperative Outcome in 4432 Patients Consecutively Treated at the Mayo Clinic During Eight Decades (1936-2015). World J Surg. 2018 Feb;42(2):329–42.
21.Leboulleux S, Tuttle RM, Pacini F, Schlumberger M. Papillary thyroid microcarcinoma: time to shift from surgery to active surveillance? Lancet Diabetes Endocrinol. 2016 Nov;4(11):933–42.
22.Sawka AM, Brierley JD, Tsang RW, Thabane L, Rotstein L, Gafni A, et al. An updated systematic review and commentary examining the effectiveness of radioactive iodine remnant ablation in well-differentiated thyroid cancer. Endocrinol Metab Clin North Am. 2008 Jun;37(2):457–80, x.
23.Sacks W, Fung CH, Chang JT, Waxman A, Braunstein GD. The effectiveness of radioactive iodine for treatment of low-risk thyroid cancer: A systematic analysis of the peer-reviewed literature from 1966 to April 2008. Thyroid. 2010 Nov;20:1235–45.
24.Verburg FA, Ahuja S, Avram AM, Bardiès M, Bernet V, Bourguet P, et al. Brief progress report from the intersocietal working group on differentiated thyroid cancer. Vol. 47, European journal of nuclear medicine and molecular imaging. 2020. p. 1345–7.
25.Durante C, Montesano T, Attard M, Torlontano M, Monzani F, Costante G, et al. Long-term surveillance of papillary thyroid cancer patients who do not undergo postoperative radioiodine remnant ablation: is there a role for serum thyroglobulin measurement? J Clin Endocrinol Metab. 2012 Aug;97(8):2748–53.
26.Differentiated thyroid cancer: Is there a need for radioiodine ablation in low risk patients? (ESTIMABL2). ClinicalTrials.gov website, [Internet]. Published April 23. 2013 [cited 2018 Jul 29]. Available from: https://clinicaltrials.gov/ct2/show/NCT01398085.
27.Mallick U, Harmer C, Hackshaw A, Moss L. Iodine or Not (IoN) for low-risk differentiated thyroid cancer: the next UK National Cancer Research Network randomised trial following HiLo. Clin Oncol (R Coll Radiol). 2012 Apr;24(3):159–61.
28.Leboulleux S, Bournaud C, Chougnet CN, Zerdoud S, Catargi BN, Cao C Do, et al. Estimabl2: Is There a Need for Radioiodine Ablation in Low Risk Differentiated Thyroid Cancer (DTC) Patients?: Results From the French Randomized Phase III Prospective Trial on 776 Patients (NCT 01837745). J Endocr Soc. 2021;5(Supplement_1):A875–A875.
29.Schlumberger M, Leboulleux S. Current practice in patients with differentiated thyroid cancer. Nat Rev Endocrinol. 2021 Mar;17(3):176–88.
30.Verburg FA, Flux G, Giovanella L, van Nostrand D, Muylle K, Luster M. Differentiated thyroid cancer patients potentially benefitting from postoperative I-131 therapy: a review of the literature of the past decade. Eur J Nucl Med Mol Imaging. 2020 Jan;47(1):78–83.
31.Mallick U, Harmer C, Yap B, Wadsley J, Clarke S, Moss L, et al. Ablation with low-dose radioiodine and thyrotropin alfa in thyroid cancer. N Engl J Med. 2012 May;366(18):1674–85.
32.Schlumberger M, Catargi B, Borget I, Deandreis D, Zerdoud S, Bridji B, et al. Strategies of radioiodine ablation in patients with low-risk thyroid cancer. N Engl J Med. 2012 May;366(18):1663–73.
33.Schlumberger M, Leboulleux S, Catargi B, Deandreis D, Zerdoud S, Bardet S, et al. Outcome after ablation in patients with low-risk thyroid cancer (ESTIMABL1): lancet Diabetes Endocrinol. 2018 Aug;6(8):618–26.
34.Dehbi H-M, Mallick U, Wadsley J, Newbold K, Harmer C, Hackshaw A. Recurrence after low-dose radioiodine ablation and recombinant human thyroid-stimulating hormone for differentiated thyroid cancer (HiLo): long-term results of an open-label, non-inferiority randomised controlled trial. lancet Diabetes Endocrinol. 2019 Jan;7(1):44–51.
35.Grani G, Zatelli MC, Alfò M, Montesano T, Torlontano M, Morelli S, et al. Real-World Performance of the American Thyroid Association Risk Estimates in Predicting 1-Year Differentiated Thyroid Cancer Outcomes: A Prospective Multicenter Study of 2000 Patients. Thyroid. 2021 Feb;31(2):264–71.
36.Durante C, Haddy N, Baudin E, Leboulleux S, Hartl D, Travagli JP, et al. Long-term outcome of 444 patients with distant metastases from papillary and follicular thyroid carcinoma: benefits and limits of radioiodine therapy. J Clin Endocrinol Metab. 2006 Aug;91(8):2892–9.
37.Giovanella L, Duntas LH. Management of endocrine disease: The role of rhTSH in the management of differentiated thyroid cancer: pros and cons. Eur J Endocrinol. 2019 Oct;181(4):R133–45.
38.Robbins RJ, Wan Q, Grewal RK, Reibke R, Gonen M, Strauss HW, et al. Real-time prognosis for metastatic thyroid carcinoma based on 2-[18F]fluoro-2-deoxy-D-glucose-positron emission tomography scanning. J Clin Endocrinol Metab. 2006 Feb;91(2):498–505.
39.Schlumberger M, Brose M, Elisei R, Leboulleux S, Luster M, Pitoia F, et al. Definition and management of radioactive iodine-refractory differentiated thyroid cancer. lancet Diabetes Endocrinol. 2014 May;2(5):356–8.
40.Pacini F, Fuhrer D, Elisei R, Handkiewicz-Junak D, Leboulleux S, Luster M, et al. 2022 ETA Consensus Statement: What are the indications for post-surgical radioiodine therapy in differentiated thyroid cancer? Eur Thyroid J. 2022 Jan;11(1).
ENLACES RELACIONADOS
https://clinicaltrials.gov/ct2/show/NCT01837745 (ESTIMABL2)
https://clinicaltrials.gov/ct2/show/NCT01398085 (IoN)
https://doi.org/10.1210/jendso/bvab048.1788 en Eur Thyroid J. 2022 Jan 111(1)e210046 doi: 10.1530/ETJ-21-0046